Т-стадирование
T-категория определяет глубину инвазии опухоли и служит одним из основных критериев для выбора тактики лечения рака прямой кишки. Глубокая инвазия в мезоректальную клетчатку (Т3с-d) увеличивает риск местного рецидива в 2,3-3 раза – с 15% до 35-45%, а поражение брюшины (T4a) или соседних органов (T4b) снижает 5-летнюю выживаемость до 40-50%. Стратификация Т3-категории по глубине экстрамуральной инвазии позволяет персонализировать показания к неоадъювантной химиолучевой терапии: при глубине инвазии >5 мм неоадъювантное лечение улучшает локальный контроль с 67% до 89%.
Общие принципы лучевой диагностики
T-категория в классификации TNM отражает степень инвазии опухоли в стенку прямой кишки и окружающие ткани.
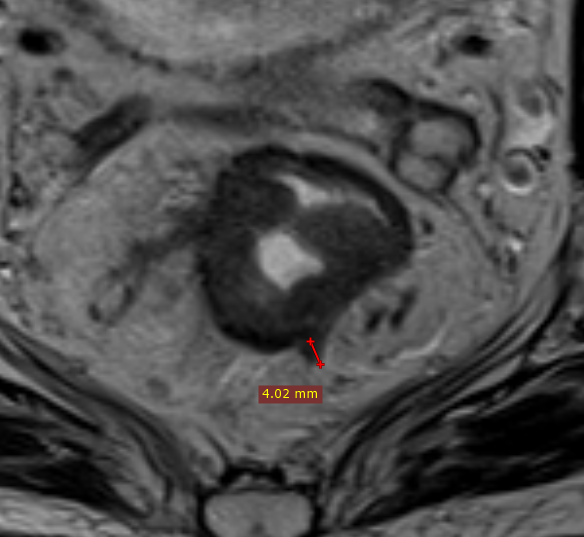
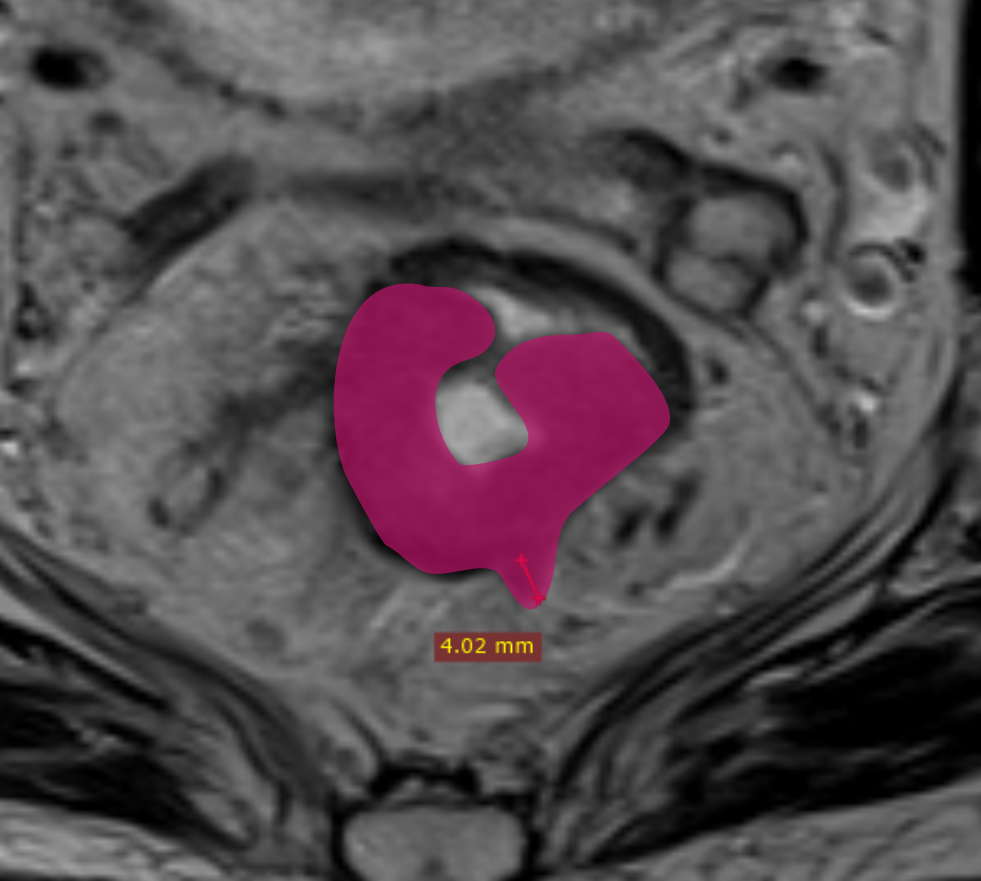
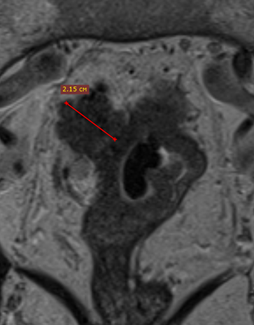
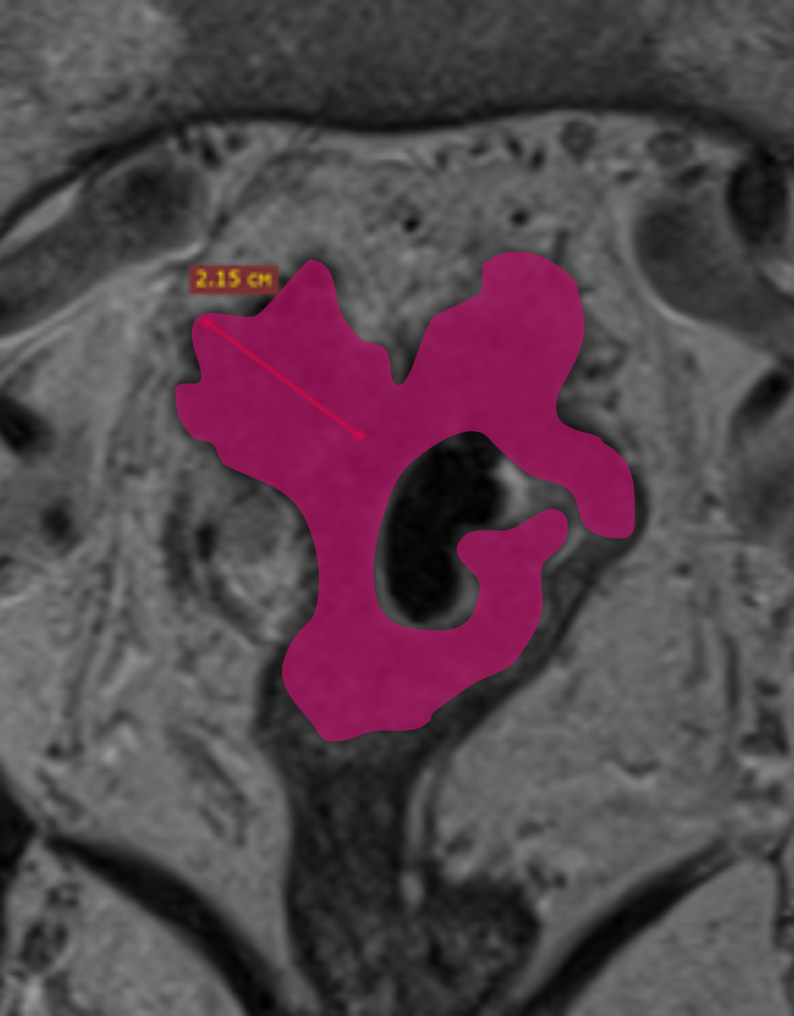
При описании необходимо определить наиболее инвазивную часть опухоли (опухолевую площадку), соответствующую области наибольшей глубины инфильтрации, которая обычно расположена в центральных отделах опухоли. Оценка глубины распространения за пределы кишечной стенки при раке нижнеампулярного отдела представляет определённые сложности из-за сужения мезоректальной клетчатки [12, 15]. Точное измерение глубины экстрамуральной инвазии позволяет уточнить потенциальную резектабельность, риск местного рецидива и степень угрозы мезоректальной фасции. Методика измерения глубины инвазии представлена на рис. 1.
МРТ и КТ не обладают достаточной точностью в определении минимальной инвазии кишечной стенки, за исключением некоторых случаев, когда на МРТ можно отчетливо дифференцировать и проследить сохраненный подслизистый слой (гиперинтенсивный МР-сигнал) в основании опухоли. Эндоректальное ультразвуковое исследование является рекомендуемым методом для точного определения Т1-Т2 опухолей благодаря высокой диагностической эффективности в оценке ранних стадий [4].
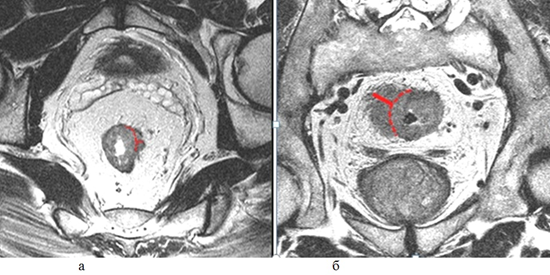
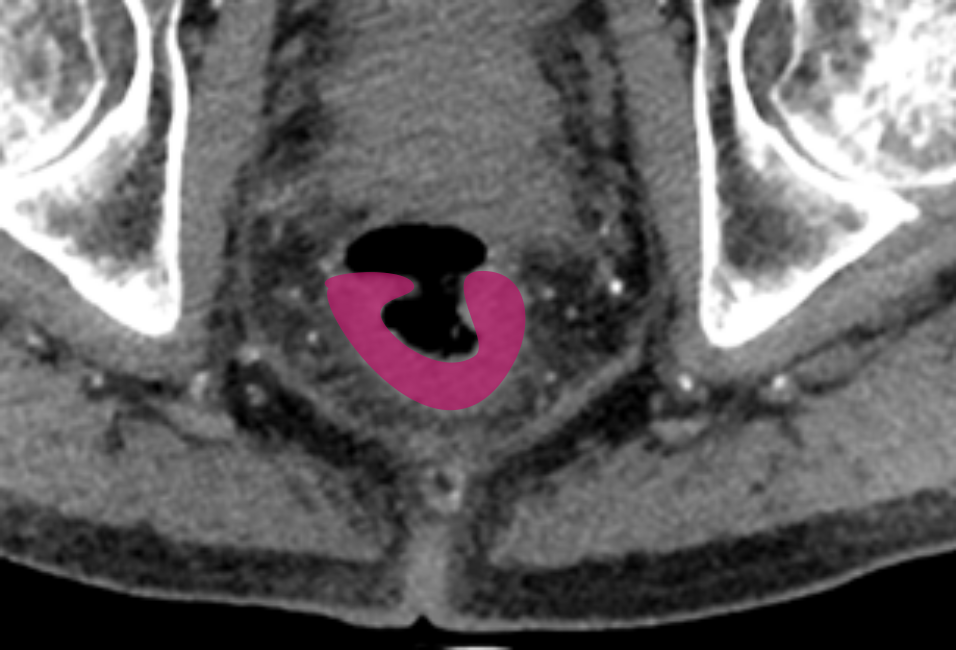
При распространении опухоли за пределы стенки кишки обязательным является измерение глубины инвазии от наружного края мышечной стенки до дистальной точки опухоли (рис. 1). Согласно последней версии клинических рекомендаций, категорию Т3 необходимо стратифицировать в зависимости от глубины инвазии клетчатки и указывать глубину экстрамурального распространения в миллиметрах в заключении (рис. 3).
- T3a – <1 мм
- T3b – 2–5 мм
- T3c – 6–15 мм
- T3d – >15 мм
Стратификация T3 важна, поскольку глубина экстрамуральной инвазии напрямую коррелирует с 5-летней выживаемостью: 85% при ≤5 мм против 54% при >5 мм [13].
МРТ
МРТ является основным методом визуализации для оценки T-категории при РПК. Оценка глубины инвазии осуществляется на высокоразрешающих косоаксиальных Т2-ВИ, строго перпендикулярных к длинной оси опухоли, на которых можно оценить структуру слоев стенки кишки и распространение опухоли за её пределы (рис. 1, рис. 2). ВР-МРТ прямой кишки при оценке T-категории демонстрирует диагностическую точность 85%, чувствительность 87% и специфичность 75% [2].
T1
При T1-опухолях инвазия ограничивается слизистой и подслизистой оболочками.
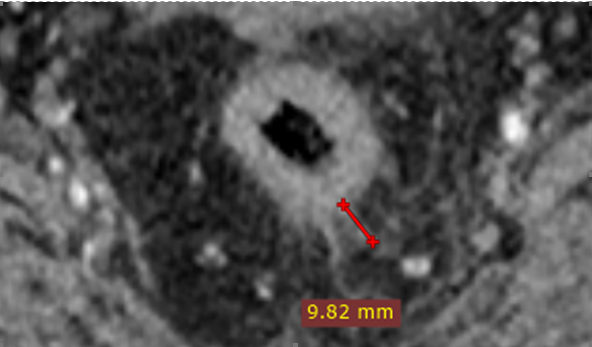
Гиперинтенсивный подслизистый слой на Т2-ВИ четко отделяет опухоль от гипоинтенсивного мышечного слоя, что указывает на T1-стадию [6] (рис. 2).
МРТ выявляет T1-опухоли с точностью 85% при использовании высокоразрешающих последовательностей [5]. Ограниченная разрешающая способность МРТ не всегда позволяет дифференцировать минимальную степень инвазии, поэтому в таких случаях предпочтительно эндоректальное УЗИ [4].
T2
T2-опухоли характеризуются гипоинтенсивным сигналом опухоли, проникающим до, но не за пределы мышечного слоя. На МРТ мышечная оболочка определяется как гипоинтенсивная полоска, часто с двумя слоями – циркулярным и продольным. Отсутствие признаков выхода опухоли в мезоректум – диагностический критерий T2 (рис. 2).
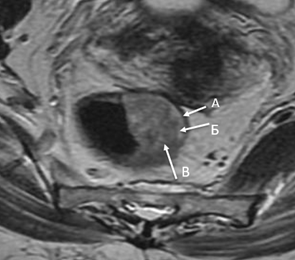
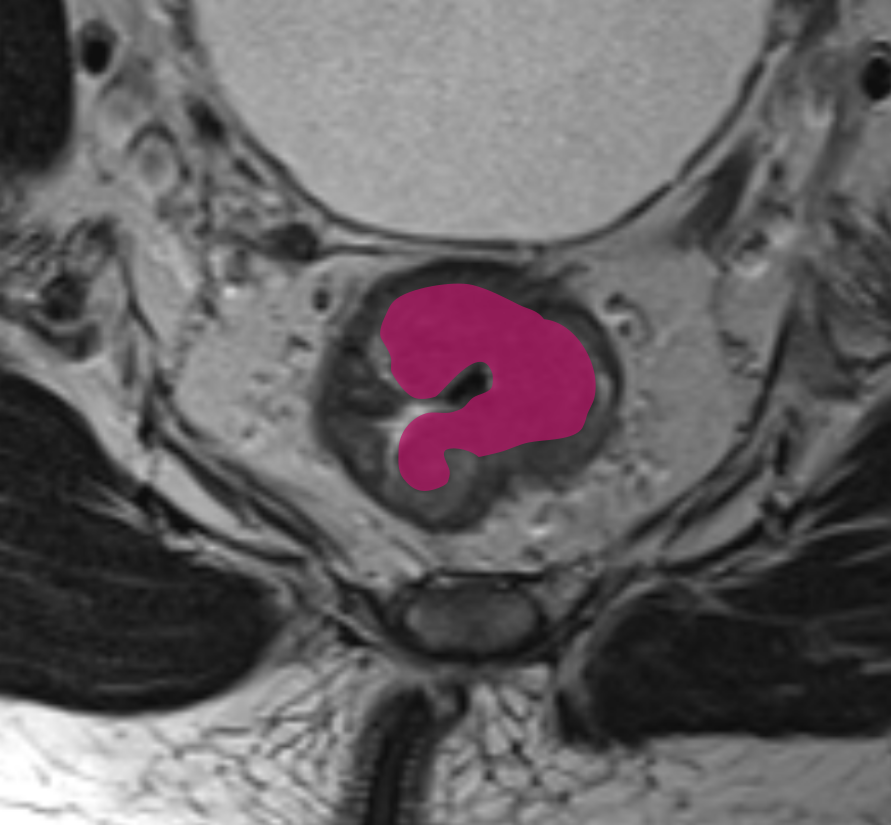
T3
T3 устанавливается при наличии экстрамурального компонента опухоли за пределами мышечной оболочки. На Т2-ВИ он выглядит как сигнал средней интенсивности, распространяющийся в мезоректальную клетчатку. Примеры различных степеней стратификации T3 опухолей представлены на рис. 3.
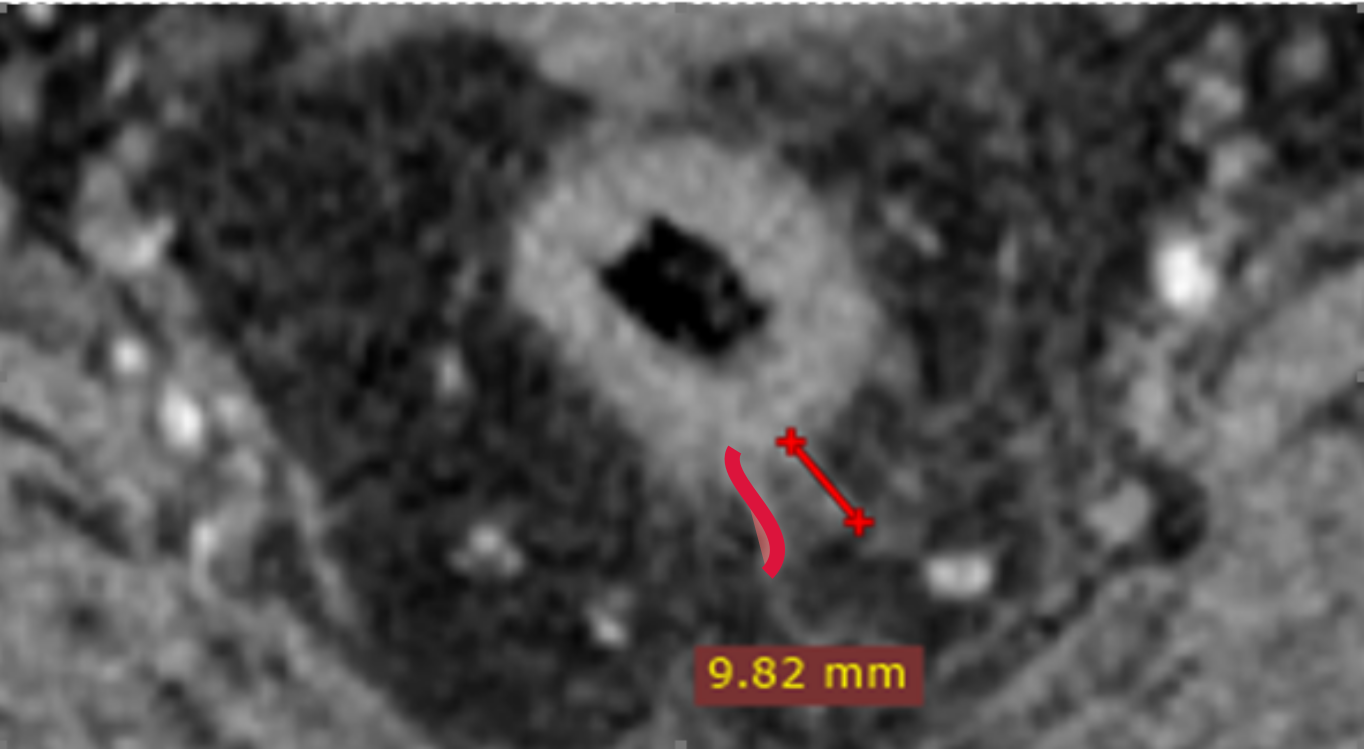
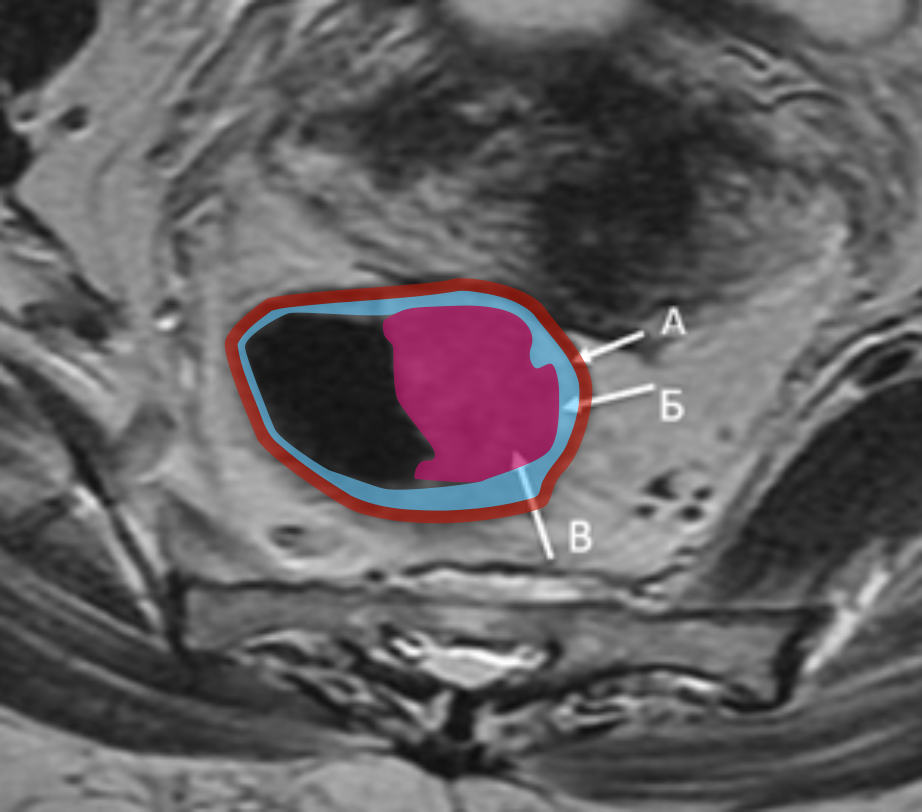
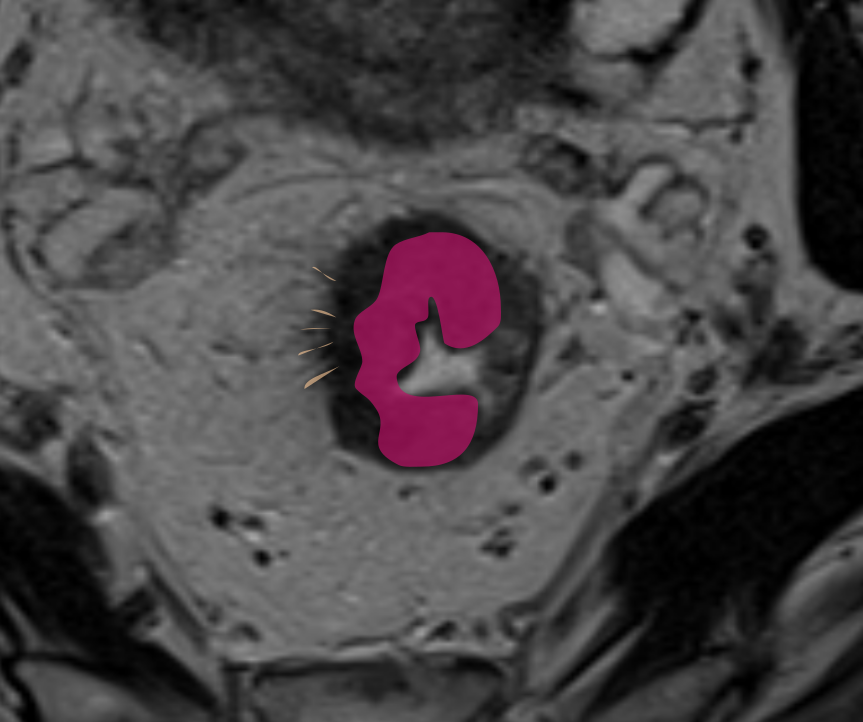
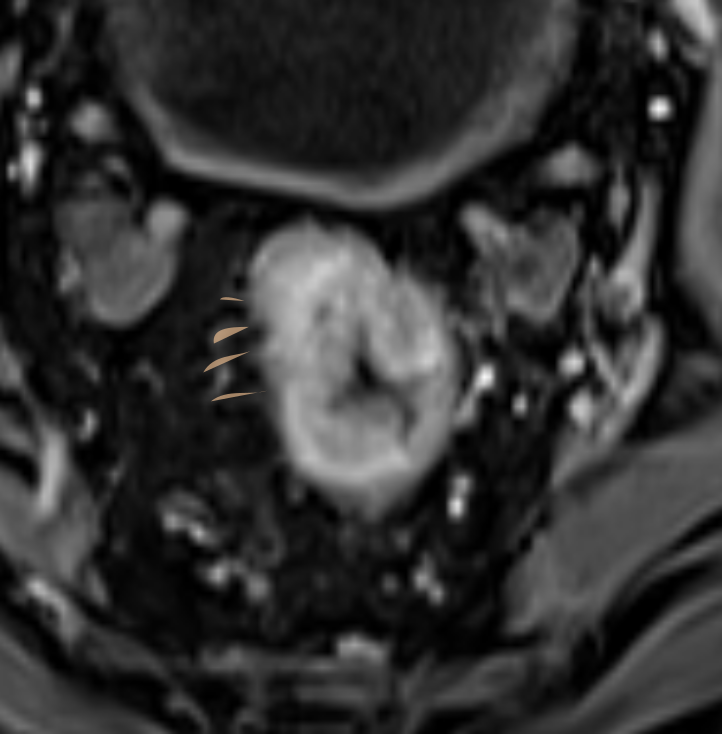
Выделяют узловое и спикулообразные тяжи опухоли.
Последнее сложно дифференцировать с перитуморальной десмопластической реакцией (рис. 4), для этого используют следующие критерии оценки:
На Т2-ВИ
- Опухолевая ткань: сигнал имеет средней интенсивности на Т2-ВИ.
- Десмопластическая реакция: гипоинтенсивные спикулы на Т2-ВИ.
На DWI
- Опухоль демонстрирует ограничение диффузии.
- Десмопластическая реакция не ограничивает диффузию, поскольку соответствует фиброзной ткани.
ДВИ превосходит контрастное усиление в дифференциальной диагностике опухоли и фиброза, поскольку фиброзные спикулы могут накапливать контрастный препарат (рис. 4) [6].
Спикулообразные тяжи в мезоректальной клетчатке рекомендуется расценивать как возможную минимальную инвазию T2/T3a (рис. 4). Четкое разграничение этих стадий менее критично, поскольку минимальная инвазия в мезоректум (<1 мм) при Т3а в ряде случаев не требует ХЛТ, аналогично Т2-опухолям [6].
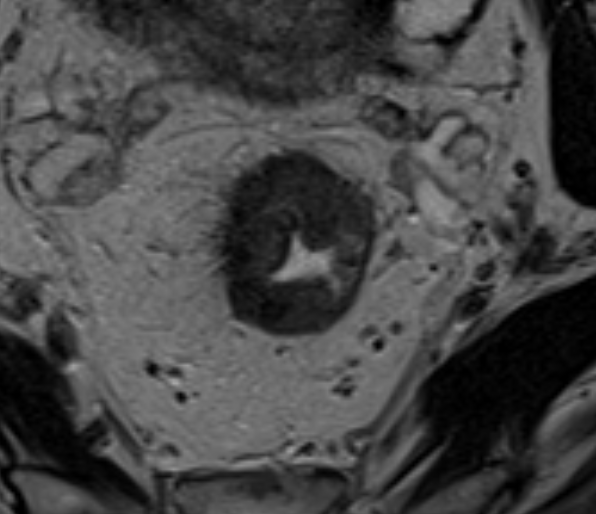


T4а
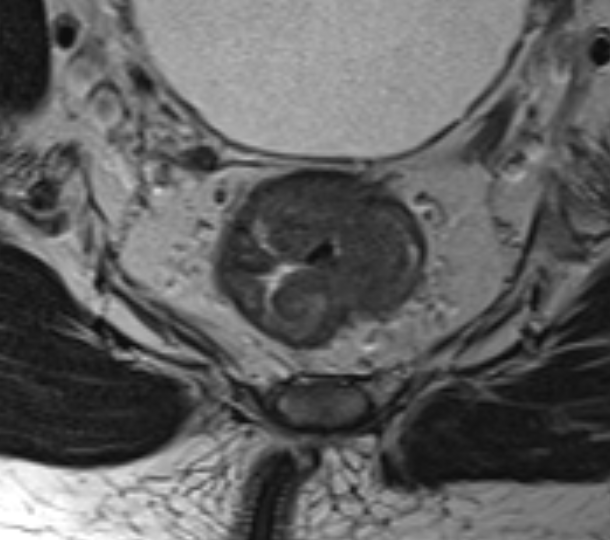
T4a устанавливается при инвазии брюшины. На Т2-ВИ брюшина визуализируется как тонкая гипоинтенсивная полоска <1 мм. Отсутствие прослойки жировой клетчатки между опухолью и брюшиной, нарушение её целостности, изменение сигнала, утолщение или узловатость брюшины указывают на T4a (рис. 5). Простое соприкосновение с брюшиной не является критерием вовлечения. Ключевое значение имеет оценка передней стенки верхнеампулярного отдела, где брюшина чаще всего прилежит к кишке.
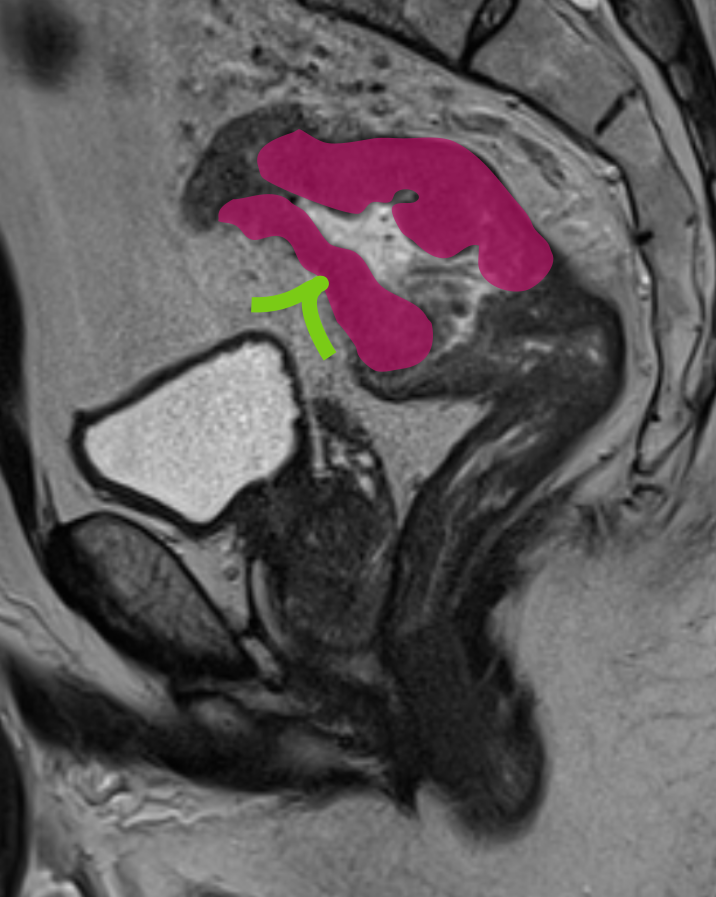
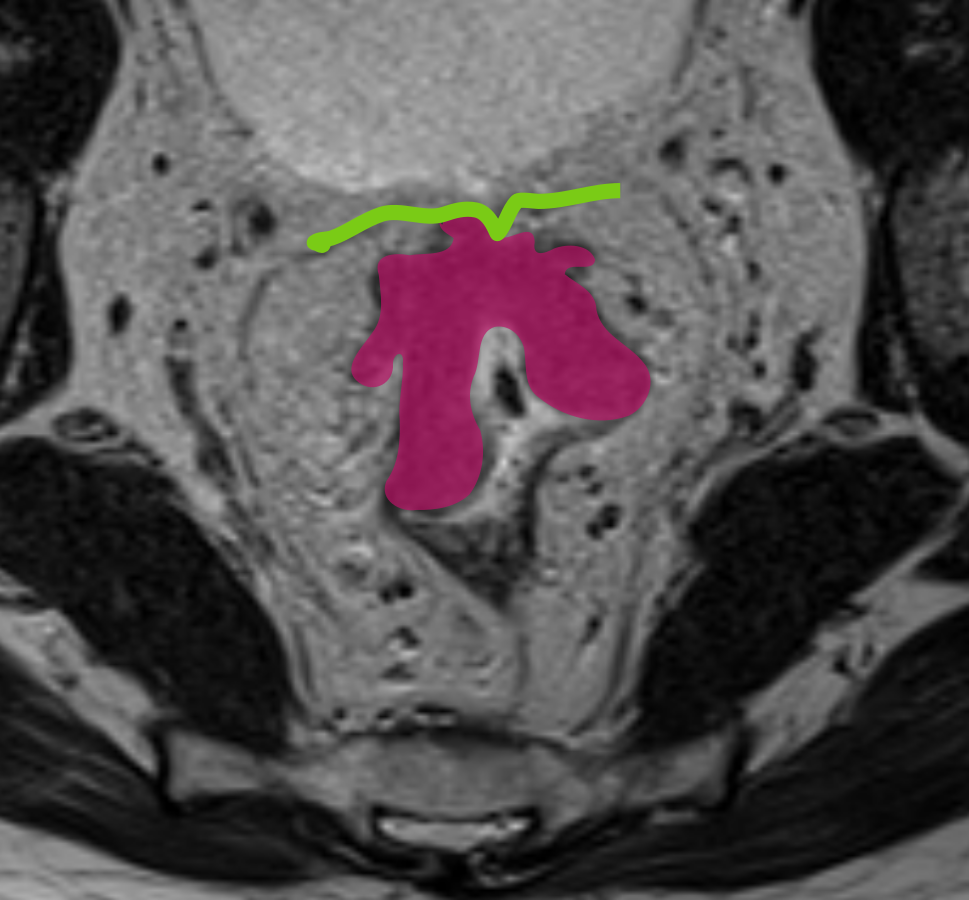
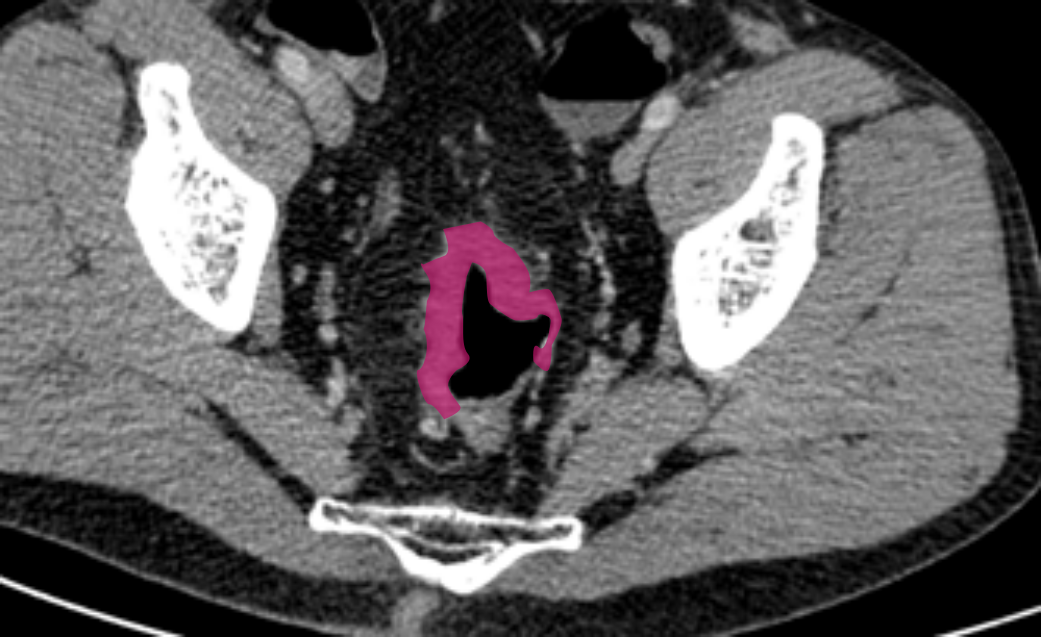
T4b
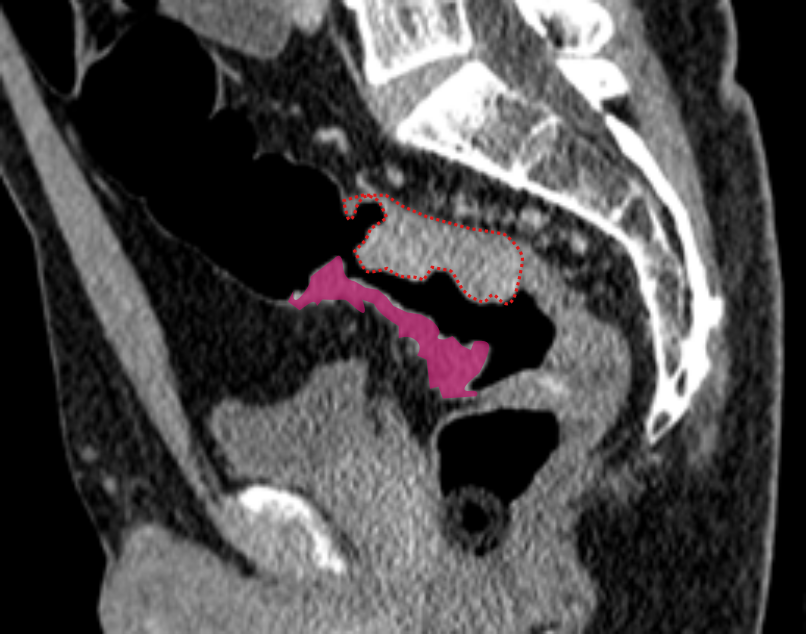
T4b включает поражение: органов малого таза (матки, яичников, влагалища, предстательной железы, семенных пузырьков, мочевого пузыря, мочеточников, костей и скелетных/поперечно-полосатых мышц, таких как запирательная, грушевидная, седалищно-копчиковая, мышца, поднимающая задний проход, и лобково-прямокишечная мышцы), а также наружный сфинктер (вовлечение внутреннего сфинктера относится к категории Т3).
Ряд консенсусов рекомендует дополнительно включать: непрямокишечные сосуды, седалищный или крестцовый нервы, крестцово-остистые/крестцово-бугристые связки и мягкие ткани за пределами мезоректума, такие как жировая ткань запирательной, подвздошной или седалищно-прямокишечной области.
Стадия Т4b устанавливается при отсутствии жировой прослойки, а также замещении структуры соседнего органа опухолевым МР-сигналом.
Выделяются три варианта отсутствия или наличия предполагаемой степени инвазии [10]:
Без инвазии – жировая прослойка чётко видна между опухолью и органом,
Возможная инвазия – прослойка не визуализируется, но нет сигнала опухоли в органе,
Явная инвазия – отсутствует жировая клетчатка между опухолью и прилежащим органом, и имеется замещение его структуры за счет участков с МР-сигналом соответствующим опухолевой ткани.
КТ
КТ определяет глубину инвазии опухоли прямой кишки с эффективностью 73-80% [8]. Мультипланарная реконструкция повышает точность до 86-87% по сравнению с использованием только аксиальных изображений [1, 8, 16].
Для оптимальной оценки T-стадии рекомендуется: использование тонких срезов (2-5 мм), выполнение мультипланарных реконструкций, ориентированных параллельно и перпендикулярно оси опухоли, внутривенное контрастирование с быстрым введением болюса контраста (≤3 мл/сек) [1, 3, 9].
Т1-2
Подслизистый слой при КТ имеет низкую плотность вследствие высокого содержания жировой ткани.
Для оценки инвазии мышечного слоя требуется определить инфильтрацию подслизистого слоя на уровне опухолевой площадки. Часто это невозможно установить достоверно, поскольку процедура требует четкой визуализации небольшой опухоли, отграничения её от неизмененной слизистой, определения подслизистого слоя и исключения других причин его истончения и деформации (расширение кишки, втяжение стенки полипом).
Косвенные критерии инвазии мышечного слоя основаны на размерах опухоли: при глубине инвазии Т1 поражается менее 1/2 окружности, при Т2 – более 1/2 окружности с трапециевидной деформацией стенки.
Дифференциальная диагностика Т1-2 опухолей на основании данных КТ нецелесообразна.
Наружный контур стенки и параректальная клетчатка обычно не изменены. Однако паратуморальный отек и десмопластическая реакция могут вызывать появление спикул или тяжистое уплотнение клетчатки. Такие изменения требуется дифференцировать с Т3 глубиной инвазии.
Т3
Неровность наружного контура стенки кишки на уровне опухоли указывает на распространение опухоли за пределы её стенки.
Опухоль может распространяться в виде спикулообразных или тяжистых изменений.
КТ не позволяет достоверно определить природу спикулообразных тяжей. Основной причиной ложноположительных результатов является перитуморальное воспаление и десмопластическая реакция вокруг опухоли. Эти изменения затрудняют дифференциацию опухолевой инфильтрации от реактивных изменений, особенно при разграничении T2 и T3 стадий [1, 8, 9, 16].
Т4
При глубине инвазии Т4 отмечается облитерация жировой прослойки между опухолью и прилежащими органами с явной инвазией в соседние органы и структуры [1, 9, 16].
Основной причиной ложноотрицательных результатов является микроскопическая инфильтрация параректальной клетчатки, невидимая на КТ [14, 16]. При несоответствии оси опухоли плоскости сканирования частичный объемный эффект затрудняет визуализацию наружного контура стенки [1]. Диагностическая эффективность значительно снижается при деформации стенки кишки, так как становится неясно, чем обусловлена неровность контура – изгибом стенки или опухолевой инвазией.
КТ и МРТ демонстрируют сопоставимую точность для глубоко прорастающих опухолей (Т3-Т4), тогда как для ранних стадий (Т1-Т2) МРТ превосходит КТ [2, 5, 11, 17].
Эндоскопическое УЗИ превосходит КТ в первичном Т-стадировании (91% против 71% соответственно) [7].