Оценка циркулярного края резекции
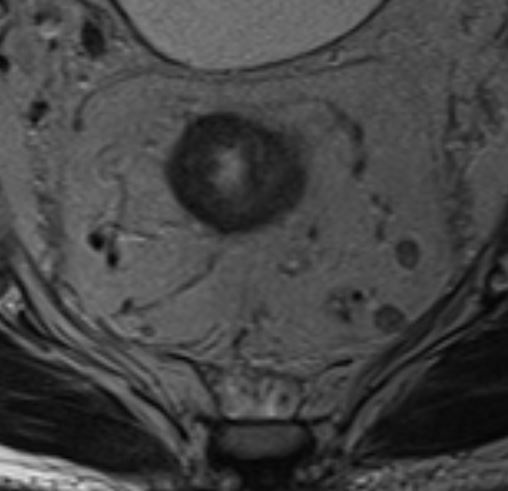
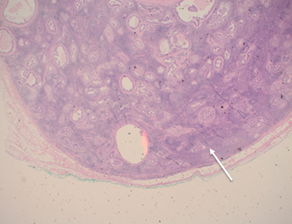
Циркулярный (латеральный) край резекции (CRM – circumferential resection margin) фактор прогноза, определяющий риск местного рецидива. CRM анатомически соответствует наружной границе мезоректальной фасции – плоскости, по которой производится тотальная мезоректальная эксцизия (TME). Положительный CRM диагностируется при расположении опухоли, метастатического лимфоузла (рис. 1), опухолевого депозита или EMVI менее чем в 1 мм от этой границы. Лучевая оценка CRM коррелирует с патоморфологическими данными в 95% случаев [13]. Положительный CRM ассоциируется с высоким риском локального рецидива, снижением безрецидивной и общей выживаемости [21]. Предоперационная оценка CRM позволяет стратифицировать пациентов по риску и определить необходимость неоадъювантной химиолучевой или лучевой терапии для достижения R0-резекции. Анатомическое сужение мезоректальной клетчатки в средней и нижней трети прямой кишки делает край резекции технически уязвимым. Опухоли нижнего уровня требуют дополнительной оценки отношения к m. levator ani и сфинктерному комплексу, поскольку положительный CRM в этой локализации чаще всего обусловлен инвазией данных структур.
Общие принципы лучевой диагностики
Концепцию CRM разработал патоморфолог P. Quirke как элемент оценки качества TME [15]. Крупное мультицентровое исследование MERCURY (2011 г.) подтвердило прогностическую значимость лучевой оценки CRM [21]. При вовлеченном CRM на предоперационном исследовании риск локального рецидивирования значительно увеличивался, а безрецидивная выживаемость снижалась [21].
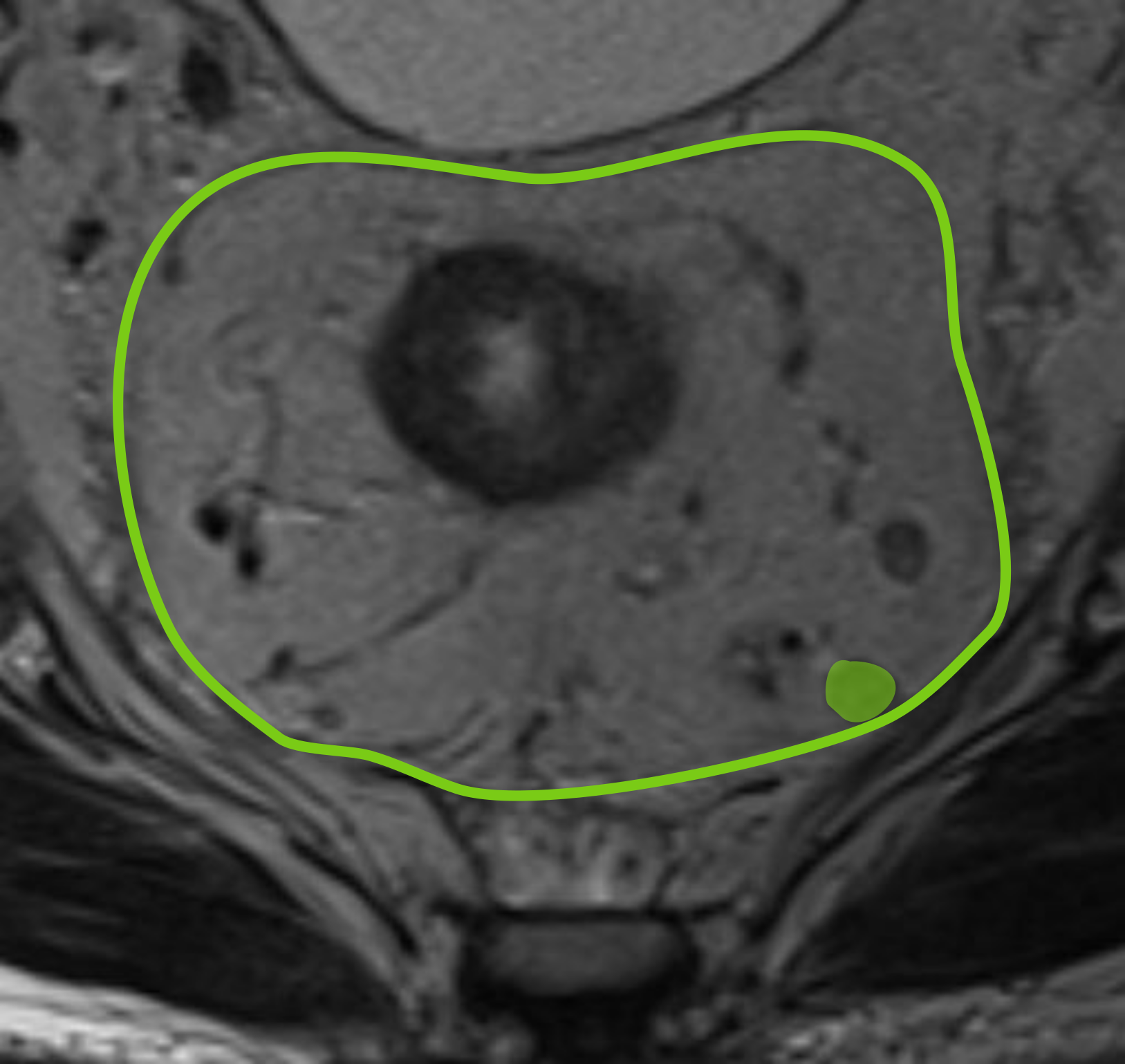
Лучевую оценку mr/ctCRM проводят по кратчайшему расстоянию от края опухоли до границы резекции (при ТМЕ – до МРФ) с указанием позиции на «часах циферблата». МРФ анатомически соответствует CRM, поэтому в современных рекомендациях используется термин MRF, а не CRM (ЦГР – циркулярная граница резекции в русскоязычной литературе). Данные понятия взаимозаменяемы при МРТ и КТ.
Ключевым показателем является минимальное расстояние в миллиметрах. Риск рецидива прогрессивно снижается при увеличении дистанции: 20% при 0-1 мм, 12% при 1-2 мм, 6% при 2-5 мм и 3% при >5 мм [9]. CRM может быть вовлечен [14]:
первичной опухолью
метастатическим ЛУ
опухолевым депозитом (N1c)
узлом EMVI
Особенности оценки по уровням прямой кишки:
CRM относится к неперитонеализированной части прямой кишки. Это важно учитывать при определении стадии опухоли и планировании лечения.
Верхнеампулярный отдел
Опухоли передней стенки верхнеампулярного отдела при распространении на брюшину стадируются как T4a. CRM на этом уровне остается отрицательным, поскольку мезоректальная фасция не окружает ПК циркулярно и локализуется только по задней и заднебоковым полуокружностям.
Низкие опухоли прямой кишки
В нижних отделах, где МРФ не определяется, оценка CRM включает отношение опухоли к m. levator ani и вовлеченность межсфинктерного пространства. Риск вовлечения МРФ на этом уровне значительно выше. Положительные хирургические края (CRM+) наблюдаются в 30% случаев [16]. Предоперационная терапия у таких пациентов может значительно уменьшить объем опухоли и потенциально позволить сохранение сфинктера.
МРТ
Высокоразрешающая МРТ (ВР-МРТ) является методом выбора для оценки потенциального вовлечения CRM (mrMRF). Мезоректальная фасция визуализируется на Т2-ВИ как тонкая гипоинтенсивная линия, отделяющая мезоректальную клетчатку от окружающих структур. Расстояние от наиболее наружного края опухоли до фасции измеряют в миллиметрах и обязательно указывают в заключении. Локализация опухолевой площадки с привязкой к условному циферблату («на 3 часах» и т.д.) необходима для хирургического планирования.
ВР-МРТ демонстрирует высокую точность определения вовлечения MRF с чувствительностью 94% и специфичностью 85% [5]. Критически важным является соблюдение перпендикулярного положения срезов к оси опухоли. Несоблюдение данного условия приводит к искажению анатомических ориентиров и ложной интерпретации расстояния до МРФ.
Классификация mrMRF:
Отрицательный (clear) — >1 мм до фасции;
Граничный/угрожающий (threatened) — 1-2 мм;
Положительный (involved) — <1 мм.
В клинической практике применяется двухуровневая система оценки MRF (положительный/отрицательный). Частота локального рецидива при отрицательном mrMRF (>1 мм) составляет около 3% [7, 20].
КТ
Чувствительность метода для оценки вовлечения мезоректальной фасции составляет 74,2% при специфичности 93,9% [23], что позволяет достаточно надежно планировать хирургическое лечение.
Диагностическая точность КТ при оценке циркулярной границы резекции (CRM) составляет 71-77% с чувствительностью 76-82% и специфичностью 67-89% [18, 22]. При оценке CRM чувствительность КТ достигает 77-93%, а специфичность 63,3-94% [3, 4]. Общая точность КТ в определении статуса CRM варьирует от 54% до 96,5% [2, 5].
КТ-признаками вовлечения CRM являются: нечеткость границы между опухолью и мезоректальной фасцией, расстояние менее 1 мм, нерегулярность или узловое утолщение наружного контура стенки кишки с распространением в периректальную клетчатку [8]. Пороговое значение расстояния 1 мм является наиболее точным для прогнозирования статуса CRM [19]. Наличие тяжей от опухоли к мезоректальной фасции указывает на вовлечение CRM [6].
Оптимальная оценка CRM требует использования тонких срезов (0,625-2 мм), внутривенного контрастирования с быстрым введением болюса (≤3 мл/сек), ректального введения контрастного вещества или воздуха после инъекции спазмолитика [10, 11]. Изображения оценивают в портальной венозной фазе. Многоплоскостные реконструкции (MPR) повышают точность диагностики CRM с 91,2% до 96,5% по сравнению с использованием только аксиальных изображений [17]. Сканирование проводят от лонного сочленения в цефалическом направлении к подвздошным гребням для максимальной визуализации мурального усиления.
Ложноположительные результаты обусловлены десмопластической реакцией вокруг опухоли, постбиопсийными и воспалительными изменениями, фиброзом, перитуморальным отеком, спикуляциями вследствие рубцовых изменений, растяжением прямой кишки и потерей жировых прослоек при кахексии, лимфатической или сосудистой обструкции [1, 11, 12, 18].
Ложноотрицательные результаты возникают вследствие микроскопического распространения опухоли, невидимого при КТ, ограниченного пространственного разрешения КТ при тонкой мезоректальной фасции, субоптимального растяжения прямой кишки, частичного объемного эффекта и артефактов от перистальтики [10, 12, 24].