Оценка экстрамуральной венозной инвазии
Общие принципы лучевой диагностики
Экстрамуральная венозная инвазия (extramural venous invasion, EMVI) представляет собой проникновение опухолевых клеток в вены за пределами стенки кишки. Механизм инвазии заключается в блокировании сосуда опухолевым депозитом с последующей инвазией его стенок и разрастанием опухолевой ткани вокруг сосуда или в распространении опухолевого процесса за пределы мышечной ткани стенки прямой кишки с инфильтрацией дренирующей вены.
Гистологически EMVI представляет собой опухолевые клетки внутри сосудов, иногда с деструкцией сосудистой стенки. Чувствительность патоморфологического выявления EMVI варьирует от 8% до 81% в зависимости от техники окрашивания и полноты срезов [10]. Лучевые методы диагностики позволяют более уверенно идентифицировать EMVI по сравнению со стандартным патоморфологическим исследованием благодаря возможности мультипланарной оценки и последовательного анализа непрерывного хода сосудов [4].
Наличие EMVI является независимым прогностическим фактором риска системного метастазирования (в первую очередь в печень), локального рецидива, метастатического поражения лимфоузлов и снижения как безрецидивной, так и общей выживаемости в 2 раза: с 74% до 33% [2, 6]. EMVI определяет тактику неоадъювантной терапии: при ее наличии может потребоваться проведение неоадъювантной терапии даже при относительно низкой T- и N-стадии. При поражении крупных сосудов (диаметр сосуда ≥6 мм) EMVI ассоциирована с худшим прогнозом и требует более интенсивной терапии [9].
EMVI не входит в систему TNM, однако большинство клинических рекомендаций (NCCN, ESGAR) требует описания EMVI в заключении как фактора риска и одного из определяющих компонентов индивидуализированного подхода к лечению.
При слиянии первичной опухоли и узла EMVI учитываются общие размеры изменений при Т-стадировании (категории Т3 и Т4). mrMRF может вовлекаться узлами EMVI, что необходимо отдельно указывать в протоколе описания.
EMVI и рестадирование
После неоадъювантной терапии дифференцировка EMVI затрудняется из-за развития фиброза или отека в венах. Переход mrEMVI+ в mrEMVI- после ХЛТ существенно улучшает 3-летнюю безрецидивную выживаемость, что делает EMVI потенциальным предиктором ответа на лечение [1, 5].
EMVI и опухолевые депозиты
Опухолевые депозиты (N1c) представляют собой узловые структуры, локализующиеся в мезоректальной клетчатке и ассоциированные с венозной инвазией. При гистологическом исследовании в них отсутствует лимфоидная ткань, сосудистые и нервные элементы.
На МРТ опухолевые депозиты характеризуются связью с расширенным сосудом и отличаются от лимфоузлов отсутствием капсулы и нечеткостью контуров. При наличии депозитов и признаков венозной инвазии в заключении указывается EMVI+, N1c. При выявлении депозитов без признаков опухолевой венозной инвазии в заключении указывается EMVI-, N1c.
МРТ
Наиболее крупный последний мета-анализ 14 исследований показал объединенную чувствительность 61% и специфичность 87% для МРТ-выявления EMVI при РПК [8].
На Т2-взвешенных изображениях EMVI проявляется как сигнал средней интенсивности в просвете венозного сосуда, соответствующий сигналу опухоли (рис. 1). При муцинозных опухолях сигнал может быть гиперинтенсивным [13, 14].
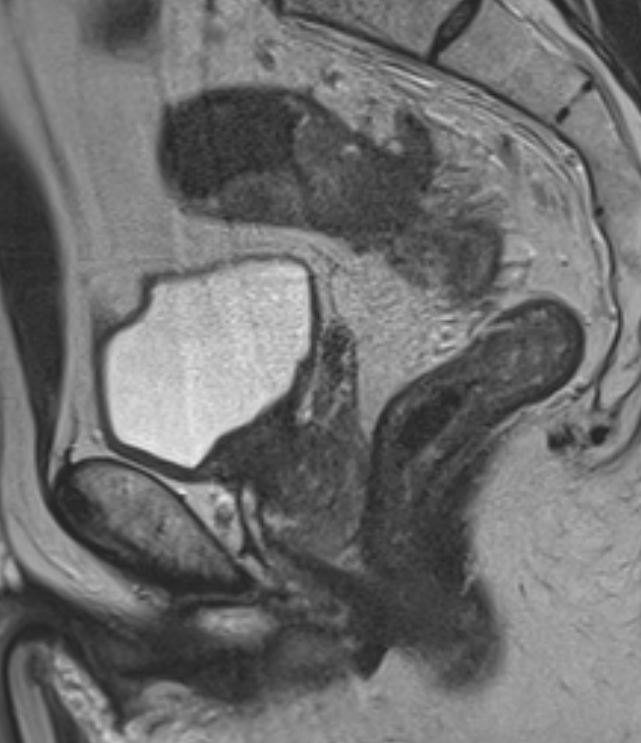
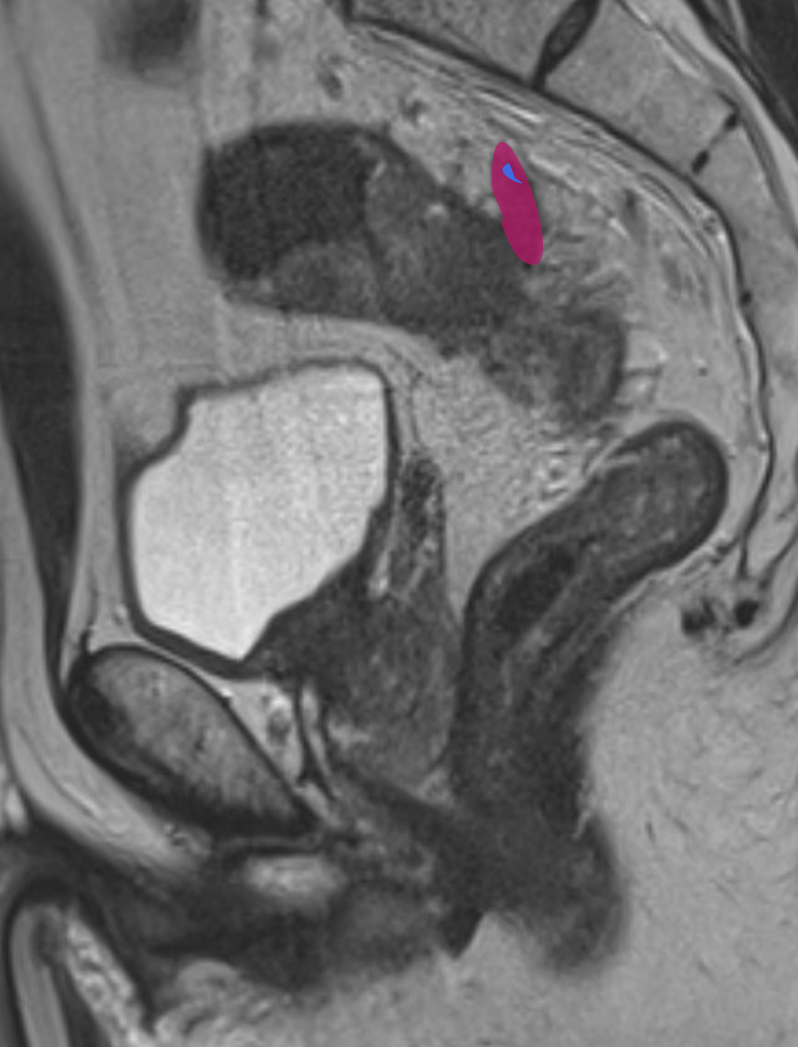
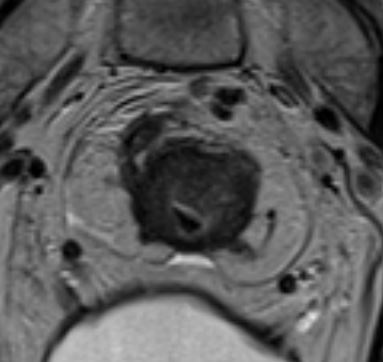
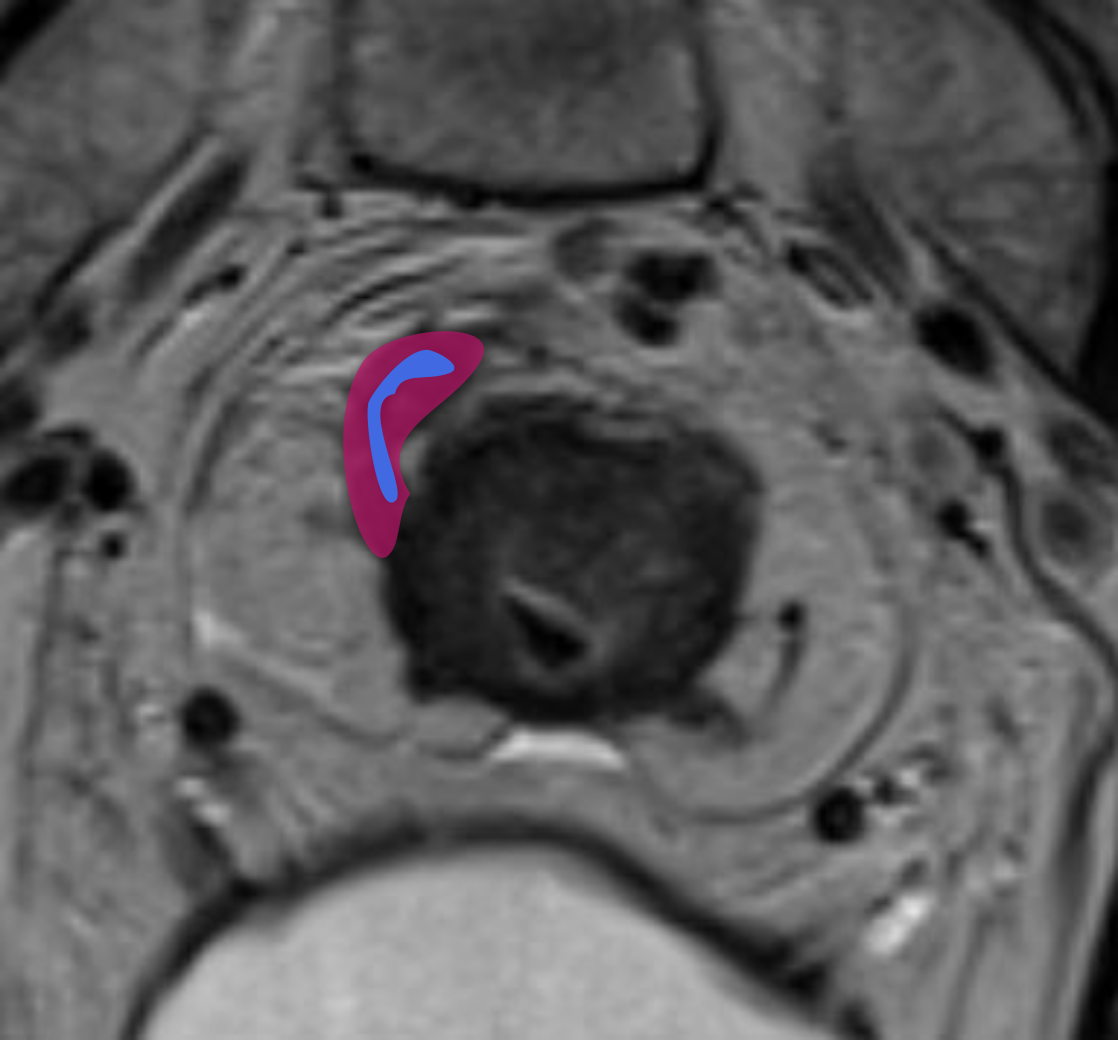
Ключевые МР-признаки EMVI на Т2-ВИ:
- расширение просвета сосуда;
- наличие промежуточного МР-сигнала от опухоли внутри сосуда;
- нарушение гладкости или прерывистость стенки сосуда;
- экстравазальное распространение опухоли из сосуда в клетчатку;
- связь с основной опухолью или опухолевыми депозитами.
Сосуды диаметром менее 3 мм не подлежат надежной оценке на предмет EMVI.
На постконтрастных изображениях EMVI проявляется как слабо- или гиперваскуляризированный внутрипросветный дефект сосуда либо как узловая структура неправильной формы, расширяющая вену. При первичной диагностике различия между МРТ с контрастированием и без него ограничены [6]. Контрастирование повышает уверенность интерпретации после ХЛТ, когда структура опухоли становится менее однородной из-за фиброза.
На DWI EMVI характеризуется повышенным МР-сигналом с признаками ограничения диффузии на ADC-картах. Диффузионно-взвешенные изображения улучшают выявление EMVI в мелких сосудах диаметром 3-4 мм за счет визуализации ограничения диффузии в тромбированных венах [12]. Данная последовательность помогает дифференцировать извитой сосуд от истинного расширения просвета опухолевой тканью.
КТ
Чувствительность КТ в оценке экстрамуральной венозной инвазии (EMVI) колеблется от 32,7% до 85%, при специфичности от 89,7% до 97% [3, 7].
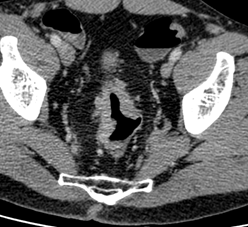
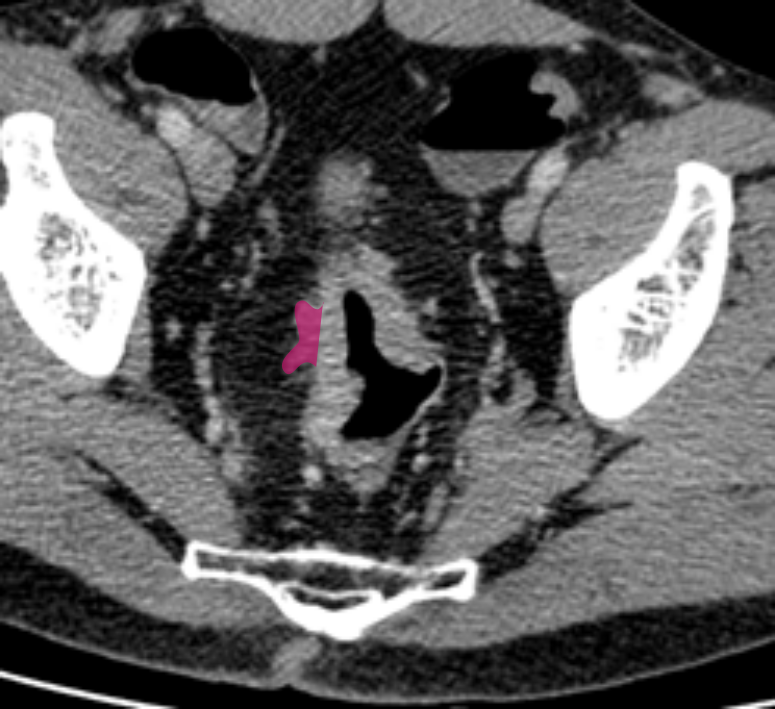
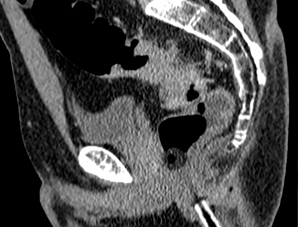
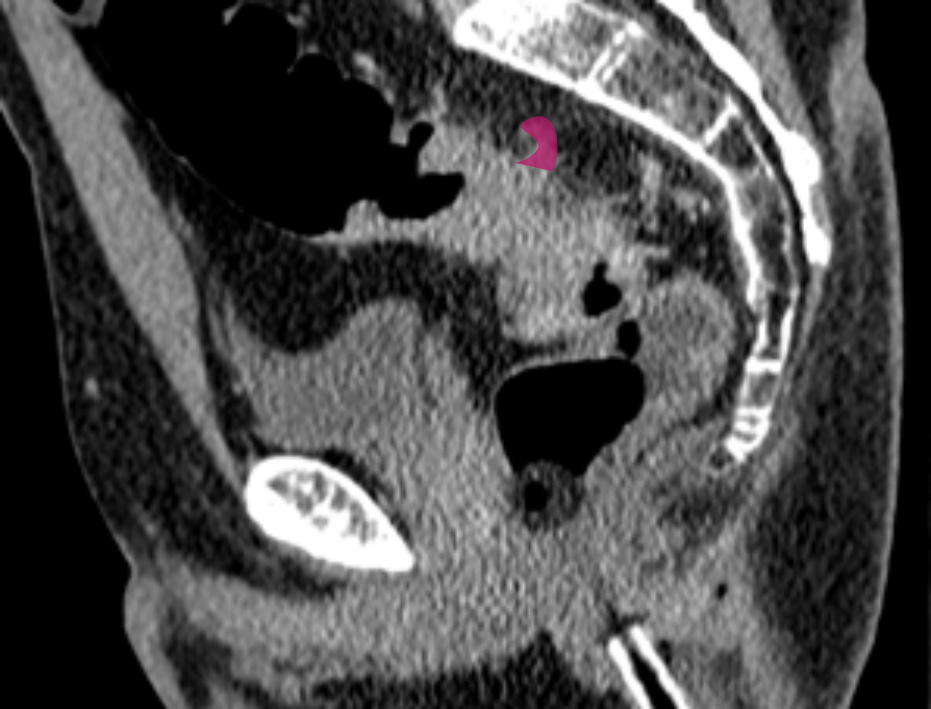
КТ-признаки EMVI включают расширение сосуда с наличием ткани опухолевой плотности или змеевидное распространение опухоли в периколическую жировую клетчатку с вовлечением сосудистых структур и нарушением контуров сосудов (рис. 2) [3, 4].
Тракция сосудов и воспалительные изменения вокруг опухоли приводят к ложноположительной диагностике EMVI в 15-20% случаев [4]. Тромбоз без опухолевой инвазии и измененная гемодинамика при местном воспалении также имитируют EMVI [11]. Микроскопические метастазы размером менее 3 мм остаются невидимыми при КТ, что обусловливает ложноотрицательные результаты.